
| Catalán | Castellano |






Manel López
Béjar
Carlos López
Plana
Fernando López
Gatius
Departamento de Sanidad y
de Anatomía Animales, Facultad de Veterinaria,
Universitat Autònoma
de Barcelona
Índice
1. Introducción
2. Segmentación
o división embrionaria
3. Morulación
4. Blastulación
5. Implantación:
Eclosión de la zona pelúcida
Anexo:
Notas sobre el término "embrión"
Prefacio
La finalidad de este atlas es facilitar el acceso a material docente que sirva de ayuda para la comprensón de la estructura, forma y fisiología del embrión en fase de preimplantación, cuando éste aún se encuentra libre en el tracto genital materno y es factible la aplicación de diversas técnicas de reproducción asistida. El embrión en fase preimplantacional es una estructura de difícil estudio, tanto por cuestiones técnicas como éticas; se trata de una estructura microscópica viva muy lábil que dará lugar a un individuo completo. Estas características hacen muy complicada su observación directa cuando es el objeto de estudio de una asignatura o curso sobre la embriología, tanto básica como aplicada a la reproducción. La embriología es una ciencia que se caracteriza por la riqueza iconográfica de sus contenidos, muy importante por la comprensión de los mismos. No obstante, hemos constatado que existe una reducida disponibilidad de textos editados que contengan material iconográfico. Por este motivo pensamos que las Tecnologías de la Información y de la Comunicación ofrecen una oportunidad importante para que los alumnos de diferentes asignaturas o cursos puedan acceder a un suporte docente virtual que facilitará la comprensión de las materias relacionadas con el embrión en fase preimplantacional.
La obra que introducimos cuenta con más de 100 imágenes microscópicas que ilustran el desarrollo embrionario en las diferentes etapas de la fase preimplantacional, las cuales los autores han ido recopilando durante más de 8 años en diferentes especies, como conejo, ratón, cabra y vaca.
En el Grado de Veterinaria de la Universitat Autònoma de Barcelona se ofrece una asignatura optativa vinculada a las biotecnologías embrionarias, para la cual se ha preparado especialmente esta obra. En esta asignatura coinciden matriculados alumnos procedentes de diversas titulaciones, no sólo de Veterinaria, para los que pensamos que puede ser útil tener acceso a imágenes y texto que hagan referencia a las diferentes etapas del desarrollo embrionario preimplantacional. El objetivo de los autores es que esta obra pueda ser utilizada como forma de enseñanza bimodal, es decir como complemento de la enseñanza presencial, por lo tanto la obra será ampliada en el futuro para incluir las técnicas más importantes de reproducción asistida, como son la producción in vitro de embriones y la crioconservación embrionaria, sin olvidar técnicas de futuro como la clonación, tanto terapéutica como reproductiva.
Indicar también que el uso de esta obra puede hacerse extensivo a todas las persones interesadas en el desarrollo embrionario preimplantacional, tanto animal como humano debido al gran parecido que poseen los embriones de diferentes especies de mamíferos en esta fase de la vida.
Por último, queremos
agradecer la valiosa e inestimable ayuda que nos ha proporcionado nuestro
amigo y compañero Dr. Joaquim Castellà, profesor de la Unidad Docente
de Parasitología y Enfermedades Parasitarias de nuestra Facultad,
muchas veces una ayuda que ha ido más allá del carácter
técnico y sin la cual no hubiéramos podido desarrollar este
proyecto. También agradecer a la Srta. Vanessa Cadenas, licenciada
en Veterinaria, la colaboración en la preparación
digital de les imágenes y en la ilusión y ánimo puesto durante la
realización del proyecto. Asimismo, queremos indicar
que en la realización de la obra han colaborado los Dr.
Pedro Mayor y Mar Fenech, becarios de nuestro Departamento, la ayuda de los
cuales queremos agradecer expresamente.
1. Introducción
"There are simple as well as complex ways of viewing the early development of mammals. In one perspective, the embryo possesses all the geometrical elegance and simplicity of a colonial organism akin to Pandorina or Volvox. Cell numbers during cleavage are few. Blastocyst formation results in only two cell types: trophoblast and embryoblast. The tasks required of the embryo during the preimplantation interval are seemingly straightforward: increase the copies of the genome; segregate the early descendants of the zygote into the two necessary cell types; make contact with the uterine lining. The complexities of organogenesis and the finer aspects of cell differentiation lie ahead. Simplicity and success seem to be the keynotes of this period."
Cole Manes, 1975. Genetic and Biochemical Activities in Preimplantation Embryos. In: CL Markert and J Papaconstantinou (ed). The Developmental Biology of Reproduction. Academic Press, New York.
De la cita anterior, realizada ya hace unos años por el Profesor Manes de la Universidad de Colorado, se extraen dos visiones bien diferenciadas, pero que conviven harmónicamente, del desarrollo embrionario preimplantacional. Este desarrollo puede considerarse simple pero a la vez elegante, si atendemos a la apariencia que se basa principalmente en divisiones mitóticas sucesiva que van aumentando el número de células del embrión. Esto daría la visión de la elegancia de formas y simetría, en muchas etapas, que mantiene el embrión durante su fase preimplantacional. La visión compleja de este desarrollo llega cuando consideramos que a partir de una única célula se obtiene todo un ser vivo con su complejidad de aparatos y sistemas, órganos, tejidos y células. Sin duda, la complejidad predomina sobre la simplicidad morfológica del proceso, principalmente porque aún hoy día hay muchos aspectos del desarrollo embrionario que quedan por dilucidar. Pese avances importantes como el conocimiento de que existen factores citoplasmáticos del ovocito que son capaces de provocar la reprogramación de un núcleo proveniente de una célula diferenciada, "olvidando toda su vida anterior", aún no hay explicaciones para muchos fenómenos que tienen lugar desde que el ovocito es ovulado hasta que el embrión formado se implanta en el útero materno.
El embrión en
fase de preimplantación ha sido objeto de numerosos estudios descriptivos
y experimentales, principalmente debido a que es ésta la fase donde el concepto
posee una mayor independencia del contacto físico materno. La primera descripción precisa del desarrollo embrionario
en fase de segmentación y blastulación data de 1875 y fue
realizada en embriones de conejo por van Beneden. No obstante, son muchos los
aspectos básicos de la fisiología, metabolismo y control genético del embrión que restan por discernir.
El avance
en la obtención de conocimientos de la bioquímica y fisiología
embrionarias ha sido más lento que en otras especies
no mamíferas, como el erizo de mar o la rana, motivado
principalmente por la reducida talla y reducido número disponible de embriones de mamíferos.
De una forma general,
los principales fenómenos que tienen lugar durante la fase de preimplantación
son, en primer lugar, el aumento del número celular, por lo
tanto un aumento de las copias del genoma embrionario y, en segundo
lugar, la diferenciación de sólo dos tipos celulares
a través de la blastulación. Además, un último
fenómeno que tiene lugar en el estadio de blastocisto es el contacto con la
mucosa uterina para su implantación.
El ovocito de los animales
mamíferos, aunque es pequeño comparado con los ovocitos de otros vertebrados, tal como peces,
anfibios, reptiles
y aves, es
una de las células más grandes del cuerpo animal. Antes de la fecundación es una de las células más inactivas, con una tasa
metabólica escasamente más alta que la de un tejido poco activo metaboólicamente como es el óseo.
Es cierto
que esta célula ya posee individualidad, en el sentido
que su complemento de genes constituye una selección única
a partir del conjunto maternal, pero su información genética
no ha estado aún utilizada, y hasta este momento, en todos sus caracteres
se parece a otras células maternas. Tres a cuatro días después de la fecundación,
el embrión puede tener menos
de un centenar de células, pero sufre cambios importantes. La tasa metabólica es ahora tan alta como la del
tejido maternal más activo metabólicamente, como es la
retina. Los patrones de síntesis del ARN y la capacidad de síntesis
proteica son ahora similares al de las células de un
organismo adulto y sus células se acercan al tamaño medio de las células de un organismo adulto. Los genes
del propio embrión han empezado a funcionar, codificando para
proteínas que son potencialmente reconocidas como extrañas
para la madre (McLaren, 1982). Posteriormente, la diferenciación empezará
dando lugar a un tejido, el trofoectodermo, altamente especializado para interaccionar
con la madre, y a la masa celular interna, que dará lugar
a todo el individuo.
2. Segmentación embrionaria
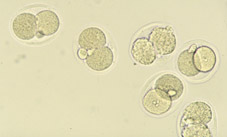
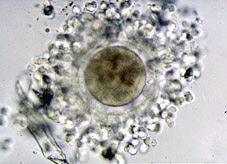
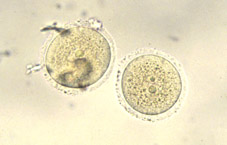
Durante el proceso de fecundación tiene lugar el paso del espermatozoide a través de la corona radiada y la penetración de la zona pelúcida del ovocito (Figs 1, 2 y 3), para conseguirse posteriormente la fusión de los núcleos de los dos gametos (Fig 4). A partir de esta fusión, todas las células del organismo en desarrollo serán portadoras, normalmente, de la dotación cromosómica completa de la especie. La estructura formada después de este proceso se llama zigoto (Fig 5). El zigoto es el elemento unicelular a partir del cual se origina el complejo cuerpo multicelular. Con esta finalidad, el primer proceso que acontece es la segmentación y se caracteriza por divisiones y subdivisiones sucesivas del zigoto, la segmentación o división embrionaria. La estructura embrionaria formada normalmente se llama embrión en segmentación, o se especifica el número de células que lo componen. Estas células se denominan blastómeras.
El diámetro del ovocito y zigoto es de aproximadamente 100 micrómetros en todos los mamíferos (Fig 6), justo el límite de visibilidad del ojo humano. Está envuelto por una fina capa no celular, la zona pelúcida (Fig 5). El estadio embrionario de una célula, debido a su tamaño relativamente grande, es distinguido por tener una baja ratio de material nuclear respecto al citoplasmático. Esta ratio, crítica por el control genético de las células en estadios más adultos, es restablecida a un valor similar al de las células somáticas mediante el proceso de segmentación, en el cual muchas divisiones celulares sucesivas tienen lugar sin ningún incremento en la masa embrionaria total (Fig 7). De hecho, el crecimiento podría ser considerado como negativo durante la segmentación, ya que la cantidad total de material celular disminuye cuasi un 20% en la vaca y un 40% en la oveja, mientras que el contenido proteico del embrión murino decrece un 25% durante los 3 primeros días post-fecundación.
Todo el período de multiplicación celular tiene lugar en el interior de la zona pelúcida, envoltura acelular que acompaña al ovocito en el momento de su ovulación. La capa de células de la corona radiada que cubría la zona pelúcida del ovocito no fecundado desaparece en este período.
La segmentación tiene lugar mucho más lentamente en mamíferos que en la mayoría de vertebrados inferiores o invertebrados. Los huevos de rana se dividen en aproximadamente una hora, pero el zigoto de ratón tarda 24 horas para realizar su primera división y de 10 a 12 horas para cada división ulterior. Otros embriones de mamíferos muestran una tasa similar de división.
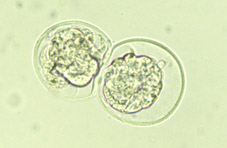
Variaciones en la tasa de división es común, tanto entre embriones como entre las células de un mismo embrión. Una consecuencia es que la sincronía inicial del embrión en segmentación temprana se pierde. Embriones con 2 y 4 células (Figs 8 y 9) son hallados más frecuentemente que aquellos de 3 y 5 células (Figs 10 y 11); al día siguiente, el estadio de 8 células (Fig 12, 13 y 14) predomina pero la variabilidad es más grande; después de 4 o 5 divisiones sucesivas, poca sincronía se mantiene (Fig 15). La primera célula a dividirse a partir del embrión de ratón de 2 células (Fig 16) contribuye en mayor manera a las células de la masa celular interna, y de forma menos marcada a la población de células del trofoectodermo.
Durante las primeras divisiones,
cada mitosis es seguida inmediatamente por síntesis de ADN en
las dos células hijas; esto quiere decir que la pausa
(período G1) previo a la síntesis del ADN, la cual es
característica de las células adultas, es
ausente. Ningún período G1 ha podido ser detectado en embriones de ratón
antes de los estadios de 8 a 16 células (Fig
17).
3. Morulación
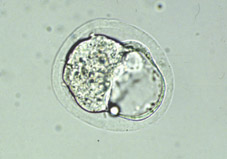
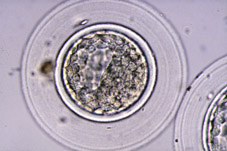
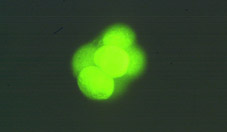
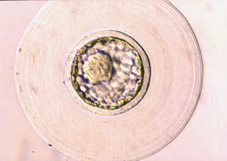
Al final del proceso de segmentación, la proliferación celular tiene como consecuencia la formación de un agregado de células, íntimamente unidas en el interior, que recibe el nombre de mórula (Fig 18). El número de células que componen la mórula varía entre especies, normalmente entre 16 y 64 células (Figs 19 y 20). La mórula viene definida por el cambio en la forma de algunas de sus células, ya que cambian de esféricas a tener forma de cuña, estado las células muy próximas entre sí para maximizar la superficie de contacto celular (Figs 21 y 22). A continuación se desarrollan uniones estrechas especializadas o uniones complejas que aproximan aún más las células de la mórula, dando lugar a una pérdida de volumen total del embrión (Fig 23). Este proceso globalmente se llama compactación y da lugar a células polarizadas por primera vez, teniendo diferenciados morfológica y funcionalmente los polos externos e internos (Fig 21). La estructura embrionaria resultante recibe el nombre de mórula compacta o compactada (Figs 24, 25, 26 y 27).
Aunque existe una cierta variabilidad cronológica entre especies
e individuos
de una misma especie, el proceso de segmentación tiene lugar a nivel oviductal
y el estadio de mórula indica el fin del período tubárico de la gestación (Figs 28
y 29).
4. Blastulación
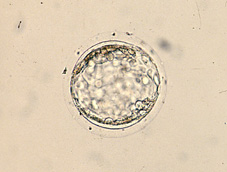

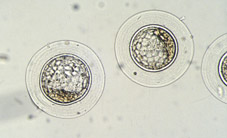
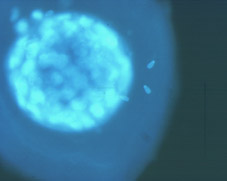
Al inicio del período uterino, las blastómeras formadoras de la mórula compacta acumulan sus secreciones en el espacio intercelular, formando unas lagunas intercelulares que provocan que las células se separen para dar lugar por coalescencia a una cavidad llena de líquido que recibe el nombre de blastocele (Figs 30, 31, 32, 33, 34, 35, 36 y 38). En este período tiene lugar el crecimiento real del volumen embrionario, principalmente a partir del aumento de volumen del blastocele (Figs 39, 40, 41, 42, 43 y 44). El embrión en este estadio se denomina blastocisto. En este estadio ya se distinguen dos tipos celulares, las células del trofoectodermo y las células de la masa celular interna (Figs 45, 46, 47, 48 y 49). El blastocisto posee una capa unicelular periférica de grandes células aplanadas, el trofooctodermo o trofoblasto (Figs 50, 51 y 52), y un grupo de células más pequeñas en un punto de la cavidad central (Figs 53, 54 y 55). Este conjunto de células se denomina masa celular interna y dará lugar principalmente al organismo adulto, mientras que las células del trofoectodermo formarán la placenta y las membranas embrionarias. El trofoectodermo forma un verdadero epitelio alrededor del blastocele, que le da al embrión un aspecto de esfera vacía, las paredes de la cual, provocado por el aumento de volumen progresivo del blastocele, se van adelgazando mediante el alargamiento de las células del trofoblasto (Fig 56). El segundo tipo celular, la masa celular interna o embrioblasto, se encuentra internamente al trofoectodermo y únicamente en un polo del blastocisto (Figs 57 y 58).
No obstante, una característica de los embriones del marsupiales es que no poseen masa celular interna, desconociéndose los factores que determinaran qué células formaran el embrión y cuáles formaran las membranas embrionarias.
Hasta este estadio, los embriones de todos los mamíferos se parecen mucho. No obstante, los blastocistos se desarrollan de forma diferente en función de la especie. En el ratón, y probablemente en la especie humana, el blastocele empieza a formarse cuando el embrión no tiene más de 20 o 30 células (Figs 59 y 60), mientras que en el momento en que la implantación empieza, el blastocisto no contiene más de 100 células (Fig 61). En el conejo, la formación del blastocisto empieza cerca de tres divisiones celulares más tarde que en el ratón, además que el blastocisto expandido contiene miles de células y mide de 3 a 4 mm de diámetro (Figs 62 y 63). En la oveja y la vaca, el blastocisto se alarga gradualmente y puede llegar a una longitud de 20 cm antes de la implantación en la segunda o tercera semana de gestación (Fig 64 y 65). En los cerdos, el proceso de elongación es más acentuado entre los días 9 y 16 de gestación; el blastocisto sufre un proceso de elongación 300 veces más acentuado que en los rumiantes, cambiando de una vesícula esférica pequeña a un tubo alargado de más de un metro de longitud, antes de que la verdadera implantación empiece.
El momento en que la cavidad blastocélica aparece no está relacionada con el tamaño del embrión. Si 3 blastómeras de un embrión de 4 células son destruidas, la célula superviviente continua su desarrollo, formándose el blastocele en el momento usual, pero dando lugar a un blastocisto con un tamaño 4 veces inferior a un blastocisto normal (Figs 66 y 67). Si un embrión es disgregado en células aisladas, una vesícula llena de líquido aparece de forma frecuente en las células individuales en el momento en que el blastocele se formaría, sugiriendo que el fluido se origina inicialmente por acumulación intracelular.
La característica más importante del blastocisto es su diferenciación en trofoectodermo y masa celular interna. La diferenciación es el punto central del misterio aún no resuelto del desarrollo embrionario, ya que de un solo óvulo fecundado se forman todos los tejidos de un organismo adulto, incluyendo diversos tipos como hueso, encéfalo, espermatozoides, etc. Las células del trofoectodermo aparecen relativamente especializadas, son grandes y aplanadas con numerosas microvellosidades, formando la continua y cerrada pared del blastocisto. Estas células constituyen 2/3 partes del total de células del blastocist. Investigaciones con microscopia electrónica han mostrado que sus membranas están íntimamente unidas e interdigitadas, ancladas en intervalos por uniones de tipos estrecho. Estas uniones estrechas ya han estado observadas en los embriones de 8 a 16 células. Funcionalmente, el trofoectodermo actúa como una bomba de iones, la cual es responsable del transporte activo de iones entre el medio externo y el blastocisto, y así es responsable indirecto del paso de fluido al interior del blastocele. Más tarde, el trofoectodermo dará lugar a células trofoblásticas primarias, las cuales son las primeras en contactar con el tejido materno, invadiendo las capas del endometrio. En cambio, las células de la masa celular interna son pequeñas, redondeadas, con una alta tasa mitótica, mostrando mínimas adhesiones o especializaciones hasta que la implantación tiene lugar. La diferenciación también se manifiesta a nivel bioquímico, ya que las células de la masa celular interna y el trofoectodermo sintetizan diferentes poblaciones de proteínas.
El siguiente tejido
a diferenciarse es el endodermo primario o hipoblasto, el cual se forma a partir
de la capa de células de la masa celular interna
que está en contacto con el blastocele. Las células
del endodermo migran por toda la superficie interna del trofoectodermo.
Después de la implantación, estas células
jugaran un importante papel nutritivo para el embrión, pero no
darán lugar al definitivo endodermo embrionario. La porción restante
de la masa celular interna es ahora nombrada epiblasto,
el cual dará lugar en la gastrulación al ectodermo, mesodermo y definitivo endodermo
embrionario.
5. Implantación: eclosión de la zona pelúcida
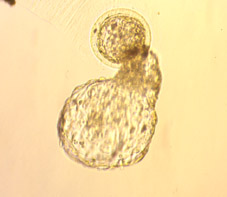
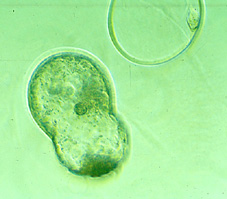
Al inicio de la implantación, los blastocistos de diversas especies (no en el caso de los embriones de conejo) presentan la eclosión espontánea de su zona pelúcida (Figs 68, 69, 70, 71, 72, 73, 74, 75 y 76). Este es un proceso de eliminación de una capa acelular externa que ha mantenido cohesionadas las células durante el desarrollo preimplantacional y que probablemente ha evitado la respuesta inmunitaria del útero materno.
Se inicia en este momento el verdadero proceso de implantación con un cambio de tipo nutricional del embrión, que pasará de nutrirse de las secreciones de los órganos tubulares maternos a depender de la sangre materna tras la placentación.
Esta obra finaliza con el período de implantación, hasta ese momento, el embrión circulaba libremente por el tracto genital femenino y permite su obtención de forma no lesiva, hecho que es utilizado para la aplicación de técnicas de reproducción asistida, incluyendo la transferencia embrionaria.
Anexo: Notas sobre el término "embrión"
La reproducción
sexual de los animales mamíferos puede dividirse de forma general en cuatro grandes períodos (Nomina Embryologica Veterinaria, N.E.V.,
1994). Estos períodos son, cronológicamente: gametogénesis y los períodos preembrionarios, embrionario
y fetal.
La gametogénesis
incluye los procesos de espermatogénesis y ovogénesis.
El periodo preembrionario engloba una serie de procesos que van desde la ovulación e inseminación o cópula hasta la neurulación, pasando por la fecundación, la blastogénesis o segmentación, la blastulación y la gastrulación.
Posteriormente, la formación del tubo neural lleva al inicio del período embrionario, en el cual es más correcto la utilización del término "embrión". No obstante, la expresión "embrión" se utiliza en la mayoría de ocasiones como sinónimo de aquella estructura reproductiva ya fecundada que mantiene relación con el tracto reproductor genital femenino, tan inmersa en sus secreciones en los estadios iniciales como después de la implantación.
En ocasiones, el termino embrión suele ser cualificado como preimplantacional o en fase de preimplantación para definir que éste se encuentra libre en las secreciones oviductales o uterinas. De una forma más concreta, el termino embrión se suele acompañar del nombre de células que lo componen en ese instante (es decir, un embrión compuesto por cuatro células se suele denominar embrión de cuatro células o en estadio de cuatro células), desde que se encuentra como una célula única (embrión de una célula o zigoto) hasta que posee de 16 a 32 células. A partir de este momento el termino embrión se suele substituir por el de mórula o blastocisto, según si se encuentra un número de células compactadas que no permite un recuento sencillo o se ha formado una cavidad central llena de líquido nombrada blastocele, respectivamente.
Diversos autores han intentado extender el uso de un término más correcto que el de embrión para definir esta estructura preembrionaria en fase preimplantacional. De esta manera, Whittingham (1975) empleó la expresión de embrión joven ("early embryo"). Por su parte, Jones (1990), motivado por la dificultad de establecer los límites éticos y morales de la manipulación de embriones humanos, optó por utilizar el término de preembrión ("pre-embryo"). Jones definió esta estructura como aquella existente desde el proceso de fecundación hasta la aparición de la línea primitiva, cuando ya ha tenido lugar la implantación. No obstante, la formación del surco y pliegues neurales, de la notocorda, de los somitos, de las cúpulas ópticas y de la placoda ótica tienen lugar también durante el período embrionario (N.E.V., 1994). Barone (1978), en su estudio descriptivo del desarrollo de la gestación, utilizó los términos de "huevo segmentado", mórula y blastocisto para definir las estructuras en fase de preimplantación. Esta terminología fue la más empleada en los estudios embriológicos de la época. No obstante, Betteridge (1977) utilizó el término embrión como sinónimo tanto de ovocito fecundado como de mórula, de blastocisto o de blastocisto expandido. Esta última acepción del término embrión es la que ha tenido una mayor utilización en los estudios experimentales reproductivos y de reproducción asistida, tal como el cultivo in vitro y la crioconservación de embriones.
El término utilizado
en el presente estudio para definir esta estructura reproductiva, ya fecundada
y en fase de preimplantación (ya sea con localización oviductal
o uterina), ha sido el de embrión y cualificada como a preimplantacional
o concretando su estadio. El uso de este término se ve motivado por su gran extensión en la terminología reproductiva, lo que comporta
que este uso tenga como objetivo una mayor coherencia y homología con la terminología mayormente empleada.